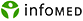Universidad de Ciencias Médicas de Pinar del Río.
Lesiones premalignas del cuello uterino. Etiología y prevención.
Autores:

Dra. Inalvis de la C. Cruz Hernández1, Dr. José G. Sanabria Negrin2 Dra. Margarita Llanuch Lara3, Dr. Amado Crespo Dueñas4, Lic. Isabel Paredes Torres5, Lic. Arioska Matos Rodríguez6.
1Especialista de Primer Grado en Medicina General Integral, Profesora Asistente de Histología. 2Especialista II Grado en Histología. Doctor en Ciencias Biológicas, Profesor Auxiliar. Investigador Auxiliar. 3Especialista II Grado en Histología. Profesor Auxiliar. 4Especialista de Segundo Grado en Histología, Profesor Auxiliar. 5Licenciada en Biología, Asistente de Histología. 6Licenciada en Cito-histopatología. Asistente de Histología.
Una de las patologías más frecuentes con las que el hombre ha tenido que luchar en las últimas décadas es el cáncer. Los países industrializados y aun aquellos en vías de desarrollo, se han dado a la tarea de combatirlo, realizando grandes esfuerzos e invirtiendo sumas de dinero con el propósito de conocer el origen, darle seguimiento a esta enfermedad y buscar alternativas que ayuden a eliminarla o a limitarla. Todos estos experimentos han permitido dilucidar algunos factores potenciadores o estimuladores para la aparición de esta patología1.
Dentro de los procesos malignos que afectan a la mujer a escala mundial, el segundo lugar en frecuencia le corresponde al cáncer cérvico-uterino, reportándose alrededor de 500,000 nuevos casos anuales y superado únicamente por la patología mamaria. Por su mayor incidencia en edades más tempranas que el de mama, el cáncer de cérvix es considerado una de las neoplasias malignas más devastadoras 1. A pesar de que las cifras reportadas son alarmantes, con la introducción de la prueba citológica cervical en la década del 40, las muertes por esta patología han disminuido en un 70% en las últimas cinco décadas 2.
El examen histológico se distingue dos tipos principales de carcinoma de cérvix: el escamoso (80-90%) y el adenocarcinoma (10-20%)3. Constituye el 12% de las neoplasias que se diagnostican en pacientes del sexo femenino, ocupando en los países en desarrollo el lugar cimero dentro de los procesos malignos que afectan a la mujer. Entre las áreas geográficas más afectadas por la enfermedad, figuran América Central, América del Sur, el Caribe, África Subsahariana, India y otras partes de Asia. En la región del Caribe, es Haití el país de mayor incidencia de cáncer de cérvix (>40 por 100 000 mujeres), en tanto que Cuba es la nación latinoamericana con más baja tasa de mortalidad, con una tasa cruda de 27 por cada 100,000 y cuarto en mortalidad con una tasa cruda de 7,50 por cada 100,000 4, 5.
Desde el año 1967, el Ministerio de Salud Pública viene desarrollando un programa nacional para el diagnóstico precoz de la enfermedad. No obstante a pesar de los esfuerzos, constituye esta la segunda patología tumoral más frecuente en Cuba y la tercera causa de muerte en mujeres en edad reproductiva 6, 7.
El presente trabajo va encaminado a ampliar aspectos relacionados con la etiopatogenia, anatomía patológica, epidemiología y prevención del cáncer de cérvix, para conocimiento de ginecólogos, patólogos, médicos de atención primaria y profesionales de la salud en general.
Características morfológicas del cuello uterino.
El útero está formado por dos porciones anatómicas, el cuerpo y el cuello o cérvix. Esta última, de aspecto cónico en su conjunto y 3 cm de longitud, es la parte inferior y más angosta del útero. La luz del cuello, llamada conducto endocervical, presenta dos estrechamientos, uno en cada extremo, denominados orificio interno, que se comunica con la cavidad del cuerpo y orificio externo, que se comunica con la vagina. Se le llama istmo, a una estrecha región donde el cuerpo se une con el cuello 8, 9 (Fig.1).
El cuello se subdivide en dos porciones, supravaginal, que es la parte superior más próximo al cuerpo del útero, y la porción vaginal, que se introduce en la parte superior de la vagina. En toda su extensión, está revestido por una mucosa que sufre grandes variaciones de una porción a otra. En la porción supravaginal (endocérvix) la mucosa es similar a la del cuerpo, estando constituida por un epitelio simple cilíndrico con células ciliadas y células secretoras de mucus. De este epitelio se originan glándulas grandes y ramificadas que se extienden por toda la lámina propia o estroma 8, 9.
En la porción vaginal o exocérvix, el epitelio simple cilíndrico de la mucosa se transforma en un epitelio estratificado plano húmedo que se continúa con el de la vagina. Este epitelio posee un estrato basal de células con núcleos alargados, perpendiculares a la membrana basal y escaso citoplasma; un estrato parabasal, de células poligonales y mayor cantidad de citoplasma; un estrato intermedio, con células de núcleos ovalados y abundante citoplasma y un estrato superficial, de células dispuestas horizontalmente y núcleos pequeños e hipercromáticos. Esta variación de las características celulares al ascender hacia la superficie, corresponde a una maduración celular 2, 8.
Por fuera, el resto de la pared está formada por una capa de escasas fibras musculares lisas y abundante tejido conectivo denso8, 9.
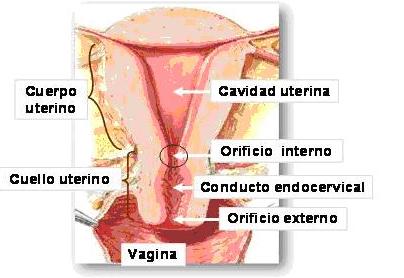
Fig. 1. Dibujo semiesquemático que ilustra el cuello uterino con su porción vaginal introducida en la parte superior de la vagina. (Tomado de Netter FH. Atlas of Human Anatomy. New Jersey. CIBA-GEIGY Corporation; 1989. Modificado).
En la zona de transición, sitio donde el epitelio simple cilíndrico mucosecretante del conducto endocervical se transforma en el epitelio estratificado de la porción vaginal del cuello, pueden aparecer alteraciones, en especial después de los partos, que consisten en parches de epitelio simple cilíndrico en la porción vaginal del cuello Estas áreas anómalas llamadas erosiones, son susceptibles de desencadenar una reacción inflamatoria. La inflamación crónica no tratada que se asocia con las erosiones, puede ser un factor predisponerte al cáncer de cuello uterino 8.
Las células epiteliales del cérvix se exfolian constantemente hacia la vagina, de modo que los extendidos de células coloreados con la técnica de Papanicolaou son de gran utilidad en la detección del cáncer cervical 8 (Fig. 2).
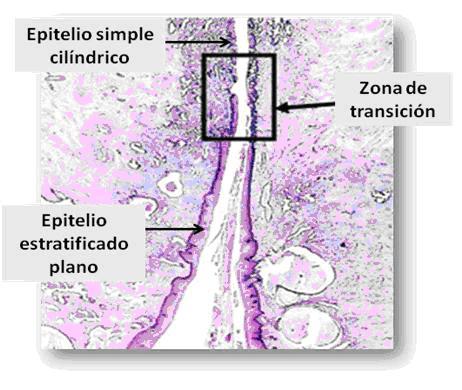
Fig. 2: Microfotografía del cuello uterino, donde se señala la zona de transición (área limitada por el rectángulo), entre el epitelio simple cilíndrico mucosecretante del conducto endocervical y el epitelio estratificado de la porción vaginal del cuello. (Tomado del laminario virtual del curso de Histología II en formato digital. Modificado).
Etiopatogenia.
El cáncer cérvico uterino es una tumoración maligna del cuello uterino que aparece a partir de un cambio en las células que revisten las paredes del mismo. Estas células inicialmente sin cambios estructurales, gradualmente se van transformando en precancerosas y eventualmente en células cancerígenas. Sin embargo, en más del 50 por ciento de las mujeres con lesiones precancerosas, las células permanecen benignas. Con frecuencia, en sus etapas iniciales este cáncer no muestra síntomas, por lo que a menudo no se detecta hasta que se hace severo 1.
El virus del papiloma humano (VPH) es el agente etiológico infeccioso asociado con la patogénesis del cáncer cérvico uterino. Es un proceso complejo que tiene diversas facetas etiopatogénicas y también implicaciones clínicas 10.
Se les llama papilomavirus porque algunos tipos pueden causar verrugas o papilomas, los cuales son tumores benignos (no cancerosos). Comprenden un grupo de virus no envueltos, de ADN pequeño, con simetría icosaédrica, que inducen verrugas o papillomas en una gran variedad de vertebrados superiores, incluyendo al hombre. Cada tipo es asociado preferentemente con una lesión clínica especifica y con un sitio anatómico preferencial por cada epitelio escamoso, mucoso o cutáneo. El VPH tiene más de 100 tipos diferentes y se ubica en piel, boca, faringe, zona genital y ano. Este virus se adquiere por contacto sexual, ya sea durante el coito o la manipulación y debido a particularidades propias de la mujer en la zona del cuello uterino, puede generar una infección. Por la acción de hormonas y el efecto de otros agentes, las células superficiales del epitelio del cuello uterino están en constante renovación, siendo la zona de transición donde el papiloma virus actúa produciendo modificaciones en sus células 1, 3 (Fig. 3).
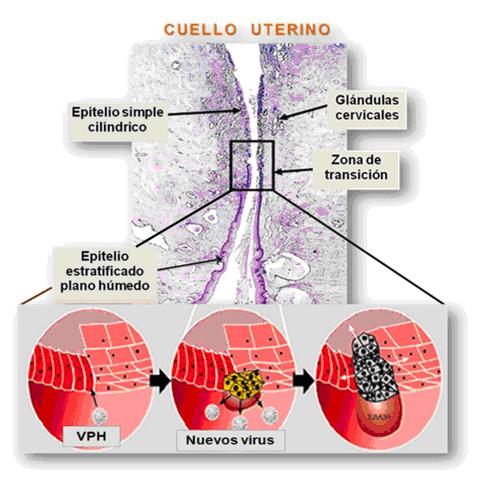
Fig. 3: Microfotografía y esquema que ilustra la invasión de la zona de transición por el VPH.
El virus del papiloma humano puede adquirirse en cualquier etapa de la vida de la mujer y el hombre, pero con más frecuencia entre los 15 y 25 años de edad, coincidiendo con la etapa de mayor actividad sexual 1, 3.
La sola presencia del VPH no causa las lesiones displásicas ni el cáncer de cervix, es decir, requiere estar asociado a otros factores de riesgo como el tabaquismo, la administración de hormonas, la promiscuidad sexual, infecciones virales, co-infección con Chlamydia tracomatis y herpes simple tipo 2, enfermedades que disminuyan la inmunidad del organismo, embarazos múltiples, desnutrición y falta de higiene 11, 12.
Globalmente se han encontrado secuencias del DNA viral entre 80 y 90 por ciento de las lesiones. Su identificación se realiza mediante el empleo de técnicas de biología molecular, usando sondas de ácido nucleico (hibridización directa o técnicas con multiplicación de la señal mediante PCR) 13.
Este virus ha sido clasificado según el grado de transformación maligna que ocasiona en la célula infestada, en virus de baja oncogenicidad: los tipos 6, 11, 40, 42, 43, 44, 54, 61, 70, 72 y 81, y de alta oncogenicidad : los tipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68 14.
Por otra parte hay tipos de virus en determinadas regiones que se encuentran con una frecuencia mayor a lo esperado, es el caso del tipo 16 en el norte de África, del tipo 18 en el sur de Asia, del tipo 45 en África sub-Sahariana y del tipo 31 en Centro y Sudamérica. A escala mundial y sin tomar en cuenta variaciones regionales, los tipos 16 y 18 son los de mayor prevalencia. Las cepas de alto riesgo (principalmente 16 y 18) pueden identificarse en más del 90 por ciento de los carcinomas escamosos invasores y en la mayoría (60-85%) de adenocarcinomas 15-17. Todos los tipos virales tienen primero una fase productiva de infección, en la cual el ADN viral flota en el núcleo, constituyendo el episoma (no está integrado al genoma de la célula). Los tipos virales oncogénicos pasan de esta fase a la fase de integración viral (o sea el ADN viral se integra al genoma de la célula epitelial). En esta condición el ADN viral interactúa con oncogenes de la célula huésped, estimulando genes que activan la proliferación celular e inhibiendo genes que suprimen la proliferación, manifestándose histológicamente como displasia epitelial 3,18. En los procesos displásicos acontece una variedad de cambios genéticos que eventualmente conducen al desarrollo del carcinoma escamoso invasor. Estos cambios son debidos a las alteraciones del ciclo celular que producen los VPH llamados de alto riesgo, y en ocasiones a la integración del propio virus en el genoma de la célula infectada. Por otro lado, existen algunas proteínas, que se expresan o bien solamente en procesos displásicos y neoplásicos, o bien con mayor intensidad en estos procesos. Estas proteínas son detectables por métodos inmunohistoquímicos y entre ellas, están p53, BCL-2, Ki-67, C-MYC, y ciclina D1 19.
Las lesiones precursoras del cáncer cervicouterino son puramente intraepiteliales es decir, se encuentran por encima de la membrana basal que separa el epitelio escamoso de la lámina propia. Se localizan en la zona de transformación o sea en la mucosa endocervical, pero con metaplasia pavimentosa del epitelio de revestimiento. En este epitelio metaplásico se producen las lesiones, las cuales son más frecuentes en la edad fértil de la mujer 20, 21.
Los cambios histológicos que caracterizan a la displasia o neoplasia intracelular(NIC), están dados por el aumento del número de capas del epitelio (hiperplasia epitelial), desdiferenciación celular (anaplasia), atipias celulares, desorden celular, aumento de la relación núcleo-citoplasma, diferentes tamaños nucleares (anisocariosis), hipercromasia nuclear y mitosis 22. Cuando estas alteraciones se encuentran en el tercio basal del epitelio, son poco acentuadas y se produce maduración más allá de esta región. Lo anterior indica que se está en presencia de una displasia leve o neoplasia intraepitelial NIC-I, en la que además, las mitosis anormales son escasas y frecuentemente coexiste con cambios coilocíticos propios del efecto citopático del VPH 23 (Fig. 4 y 5).
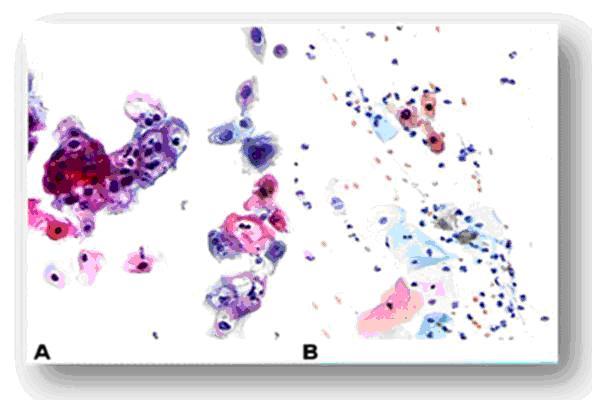
Fig. 4: Citologías alteradas. Bajo grado de malignidad.
A) Infección por el virus del papiloma humano.
B) NIC I
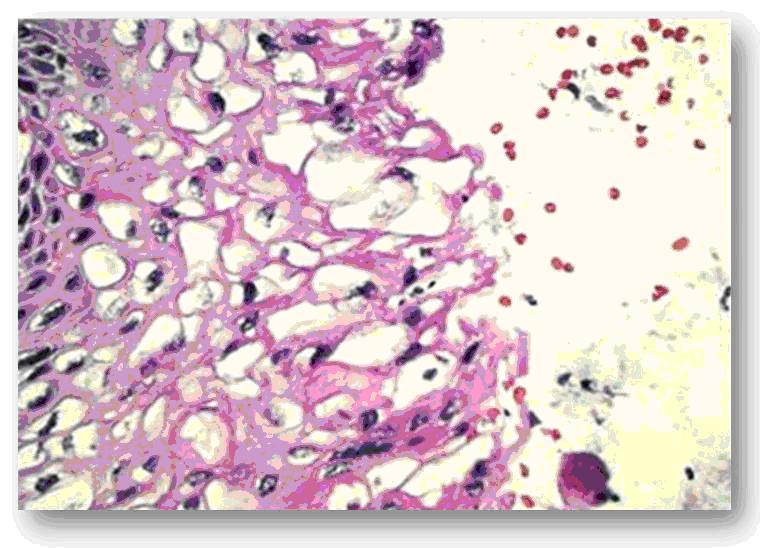
Fig. 5. Corte histológico del cuello uterino que muestra NIC I con cambiocoilocíticos.
Cuando hay maduración en las capas superficiales, las atipias nucleares se encuentran en niveles más próximos a la superficie, las mitosis se localizan en los dos tercios inferiores del espesor del epitelio y las mitosis atípicas son algo más frecuentes, cambios estos que responden a una displasia moderada o NIC-II (Fig. 6).
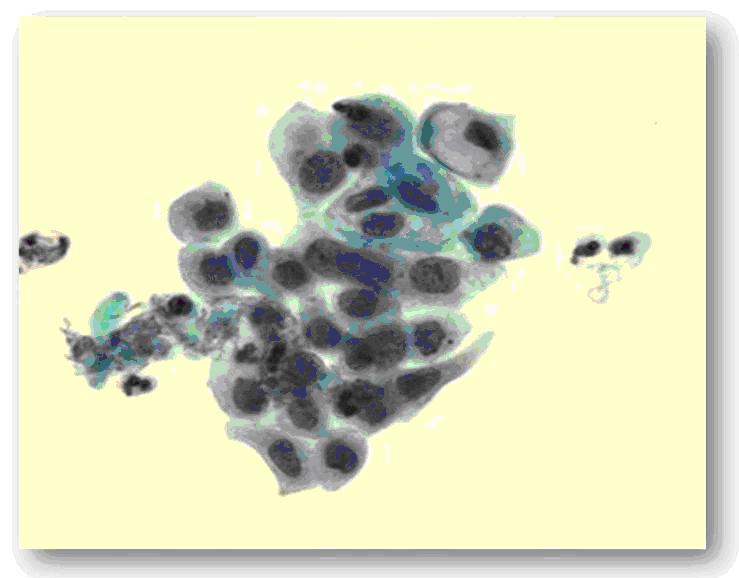
Fig. 6 Displasia de alto grado/NIC II. Se observa hipercromasia con aumento de la relación núcleo-citoplasma.
La mayoría de los casos muestran muy escasa maduración. En el carcinoma in situ, estos cambios son menos frecuentes que en la displasia severa 23. Cuando estas alteraciones son más acentuadas y comprometen más allá de los dos tercios inferiores del epitelio, pero no todo su espesor, se trata de una displasia avanzada, que junto al carcinoma in situ, donde se compromete el 100 por ciento del espesor del epitelio sin ningún signo de maduración de las células hacia los estratos superiores, constituyen un NIC-III. En este caso, las atipias nucleares se evidencian en todas las capas celulares. En la displasia severa la cromatina nuclear es menos densa y hay mayor variación en la forma y tamaño de los núcleos. (Fig. 7 y 8).
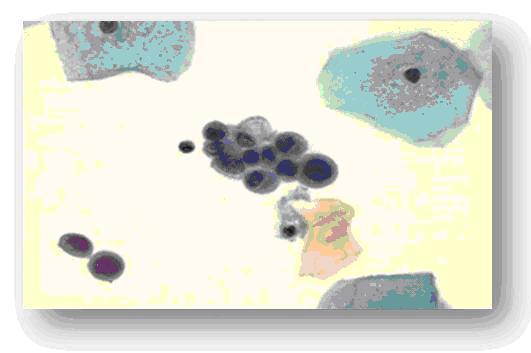
Fig. 7 Displasia de alto grado. NIC III
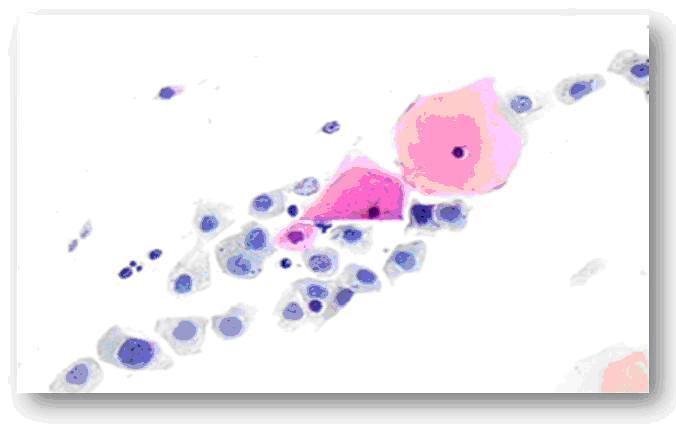
Fig. 8 Lesión de alto grado de malignidad (NIC III). Se observan células parabasales con núcleos grandes y bordes nucleares irregulares. Anisocariosis y anisocitosis.
En el carcinoma in situ los núcleos son ovoides e hipercromáticos, con sus ejes mayores dispuestos perpendicularmente a la membrana basal. La configuración nuclear es más monótona y similar en todo su espesor, a no ser que haya diferenciación escamosa superficial. Las mitosis se encuentran en todos los niveles, varían en cantidad y suelen observarse numerosas mitosis atípicas23-26 (Fig. 9).
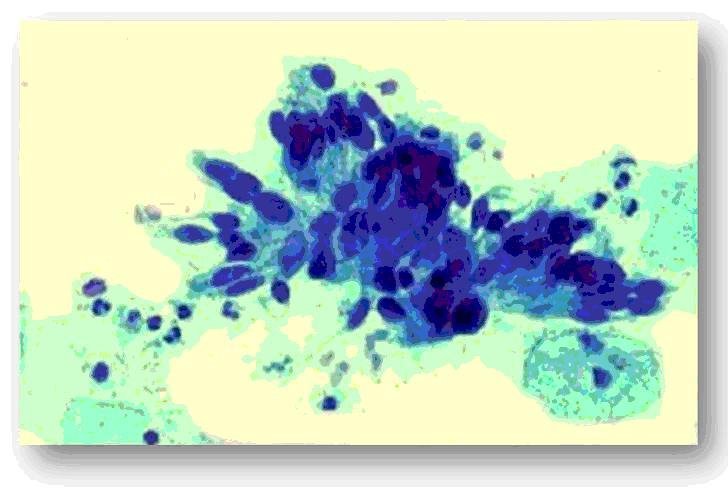
Fig.9 Adenocarcioma endocervical in situ.
Las NIC-I y la infección por VPH, se consideran lesiones de bajo grado de malignidad, mientras las NIC-II y NIC-III, son lesiones de alto grado de malignidad. El promedio de edad para los NIC I fluctúa entre los 25 y 28 años; para NIC II y III en conjunto entre 31 y 33 años y para el carcinoma invasor, la edad de riesgo se sitúa por encima de los 50 años 26.
La terminología de neoplasia intraepitelial sugiere que se trata desde un comienzo de procesos neoplásicos y que progresan continuamente desde el grado I al III y posteriormente al carcinoma invasor. Sin embargo es posible que produzca la invasión a partir de lesiones menos avanzadas del carcinoma in situ 27-28.
Prevención:
El cáncer cérvico-uterino es uno de los tipos de cáncer mas fáciles de detectar y prevenir debido a que su desarrollo es gradual. Por lo tanto el examen periódico permite diagnosticarlo antes que se propague.
La prevención primaria se basa en la no infección con el VPH, la cual solo se logra con la vacunación en etapas tempranas de la vida y con medidas dirigidas a practicar relaciones sexuales con condón, evitar relaciones con múltiples compañeros sexuales y las relaciones sexuales precoces entre otras medidas. También los factores dietéticos juegan un papel en la inmunidad del cáncer de cérvix, resultando favorecedor la ingestión de alimentos que contengan carotenoides (frutas y vegetales), la administración de vitamina C (antioxidante) y vitaminas A y E, que previenen el daño del ADN. La prevención secundaria, se realiza a través de la prueba de Papanicolau (Pap), introducida en 1943 por el Doctor George Papanicolaou, como un examen de detección temprana para cáncer cervical 29.
El Pap es una estrategia efectiva para reducir el riesgo de cáncer cervical. El mismo involucra tomar tejido del cérvix, colocarlo en una platina de vidrio y examinar bajo microscopio para detectar células anormales. Es un método con un 70 a un 80 por ciento de efectividad para detectar anormalidades celulares causadas por VPH. Un método más sensible, efectivo en un 85 a un 95 por ciento, es el “Preparado Delgado,” en donde el tejido del cérvix se pone en una solución líquida para detectar anormalidades celulares causadas por VPH. Este último test Pap se usa mayormente en mujeres mayores de 30 años. Es una combinación de test Pap-ADN HPV. Si este test da negativo, puede esperarse tres años antes de repetirlo. Se puede indicar una inspección detallada del cérvix por colposcopia si se detectan células anormales por test rutinario Pap. Un ejemplo frecuente de ocurrencia de células anormales que se encuentran en asociación con el VPH son los coilocitos 29-32. La integración del genoma viral al genoma de la célula huésped altera el ciclo celular normal y favorece su transformación neoplásica. El avance en la comprensión de esta relación virus-huésped ha conducido a diseñar una vacuna cuyo objetivo final sería erradicar la enfermedad 33.
Una nueva vacuna para prevenir el cáncer cervico-uterino está disponible. En junio del 2006 la Administración de Drogas y Alimentos de Estados Unidos, aprobó la vacuna Gardasil. Esta es una vacuna cuadrivalente. Los ensayos clínicos, realizados entre mujeres adultas con una mediana de edad de 23, mostraron protección contra la infección inicial por los serotipos 6, 11 ,16 y 18. También la vacuna Cervarix (Glaxo Smith Kline), vacuna bivalente (previene la infección por los tipos 16,18). Gardasil es la primera vacuna aprobada dirigida a específicamente a prevenir cualquier tipo de cáncer. Se recomienda para niñas entre 11 y 12 años. Puede ser administrada también a partir de los 9 años. No obstante a la vacunación, el tamizaje debe continuar tanto en mujeres vacunadas como no vacunadas 34-39.
Consideraciones finales.
La presencia del ADN del VPH y sus precursores es la causa fundamental para el desarrollo, mantenimiento y progresión de las neoplasias malignas del cuello uterino y cáncer del cérvix, por lo que el seguimiento de la población femenina mediante el programa de detección precoz, con la realización de las citologías vaginales y el testaje del VPH para la clasificación en grupos de riesgo de las mujeres infestadas, es considerado y evaluado como una alternativa de detección primaria.
Es importante mantener la validación del diagnóstico citológico e instaurar nuevos métodos de pesquizaje, como los recomendados por la OMS, mediante la prueba de inspección visual del cuello uterino con ácido acético y lugol en la atención primaria de salud, y así aumentar el poder de detección de lesiones precursoras del cáncer.
Referencias Bibliográficas.
1- Natural History of Cervical Cancer: Even Infrecuent Screening of Older Women Saves lives”.Cervical Cancer Prevention Fact Sheet. Program for Apropiate Technology in Health (PATH); noviembre 2000.http://www.path.org
2- Cervical Cytology Practice Guidelines. American Society of Cytopathology. November 10, 2000 http://www cytopathology.org/website/article, asp? Id=382.
3- Waggoner SE. Cervical cancer. Lancet 2003; 361: 2217-25. Cancer. 2006. http://www.cmedecine.com/med/topic 324.htm
4- Garcia A. Hamied O. Cervical Cancer. 2006. http://www.cmedecine.com/med/topic 324.htm
5- Registro Nacional del Cáncer. Incidencia de Cáncer en Cuba en el año 2006.
6- Cuba. MINSAP. Programa Nacional de Diagnóstico Precoz del Cáncer Cervico-Uterino. La Habana: Editorial Ciencias Médicas; 2001:9.
7- Ferlay J, Gray F, Pisani P, Parkin DM.Eds. Globocan 2002. Cancer Incidente, Mortality and Prevalence Worlwide. Version 2.0, Lyon, France, IARC Press.2004; IARC Carncer Base No.5.
8- Junqueira LC, Carneiro J. Histología Básica. Texto y Atlas. 5ta. edición. Barcelona. Ed. Masson; 2000.
9- Ross MH, Reith EJ, Romrell LJ. Histología Texto y Atlas. Buenos Aires. Editorial Médica Panamericana S.A.; 1992
10- Crum CP. Contemporary theories of cervical carcinogenesis: The virus, the host and the stem cell. Mod Pathol. 2000;13:243-251.
11- Woodman C, Collins S, Young L. The Natural history of cervical HPV. Infection. Nat Rev Cancer. 2007:7(1):11-22.
12- Bosch FX. Muñoz N, San José. Human Papillomavirus and other risk factors for cervical cancer. Biomed Pharmather 1997; 51:268-75.
13- Hubbard RA. Human papillomavirus testing methods. Arch Pathol Lab Med. 2003;127:940-945.
14- Muñoz N, Bosch FX, De Sanjose S, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med. 2003;348:518-527.
15- Muñoz N, Bosch FX, Castellsague X, Diaz M, et al. Against wich human papillomavirus types shall we vaccinate and screen? The international perspective. Int J Cancer. 2004;111:278-285.
16- Clifford GM, Smith JS, Plummer M, Muñoz N, Francheschi S. Human papillomavirus types in invasive cervical cancer worldwide: A meta-analysis. Br J Cancer. 2003;88:63-73.
17- DunneE. Unger E, Stenberg M,et al. Prevalence of HPV infection among females in the United States. JAMA, February 2007:297(8):813-19.
18- Jastreboff AM, Cymett. Role of the Human Papillomavirus in the development of cervical intraepitelial Neoplasia and Malignancy, Post grad Med. J. 2002.
19- Rev Mex Patol Clin, Vol. 54, Núm. 4, pp 150-158 • Octubre - Diciembre, 2007.
20- Lien Tamayo, Tania Varona. Infección por VPH en adolescentes. Rev. Cub. Ginec-Obst. Agosto/2006.
21- Flores, Ivonne, Bishai. Factores de Riesgo en el Cáncer Cervical en Mujeres positivas al VPH en México. Salud publica Mex; 50(1):49-58, Jan.-Feb. 2008.
22- Ponten J, Guo Z. Precancer of the human cervix. Cancer Surv. 1998; 32:201-29.
23- Grases PJ. Patología ginecológica. Bases para el diagnóstico morfológico. Barcelona: Masson; 2003.
24- Rosai J. Female reproductive system. En: Rosai J, editor. Rosai and Ackerman’s surgical pathology. 9a edición. Vol. 2. Edinburgh: Mosby; 2004.p.1530- 1534.
25- Richart RM. Natural history of cervical intraepithelial neoplasia. Clin Obstet Gynecol. 1967;10:778-784.
26- Cantor SB, Atkinson EN, Cardenas-Turanzas M,Benedet JL, Follen M, MacAulay C. Natural history of cervical intraepithelial neoplasia: a meta-analysis. Acta Cytol. 2005;49:405-415.)
27- Solomon D, Nayer R. The Bethesda System for Reporting Cervical cytology. Second Edition. 2004. Springer-Verlag. New Cork, Inc.
28- Wright T, Cox JT, Massed LS, et al. Algorithms from the consensus Guidelines for the Management of women with Cervical Cytological Abnormalities. 2002. American Society for Colposcopy and Cervical Pathology.
29- Muñoz, Nubia y Bosch, Xavier. “Cervical cancer and Human Papillomavirus: Epidemiological Evidence and Perspectivas for Prevention”. Salud Publica Mex. 39:1997.
30- Key Steps for Meeting Women´s Needs”. Cervical Cancer Prevention Fact Sheet. PATH: noviembre 2000.http://www.path.org
31- Cuzick J. Human papillomavirus testing for primary cervical cancer screening (editorial). Journal of the American Medical Association. 2000; 283(1):108-9.
32- Bosch FX, Lorinez A, Muñoz NC, Meijer JL, Shah KV. The causal relation between human papillomavirus and cervical cancer. J Clin Pathol. 2002, 55:244-65.
33- Yazegi I, Roberto. Vacuna contra VPH. Rev. Med. Clinica Condes, oct./2007.
34- Lowwy DR, Schiller JT. Prophylactic human papilomavirus vaccines. J Clin Invest. 2006 May ;116(5):1167-73.
35- Villa LL, Aula KA, Guiliano AR, et al. Immunologic responses following administration of a vaccine targeting Human papilomavurus types 6, 11, 16 and 18. VAccine. 2006 May 15[Epub ahead of print].
36- US Food and Drug Administration. FDA Licences New Vaccine for Prevention of Cervical Cancer and other diseases in Female Caused by Human Papillomavirus. Rockville, MD: Nacional Press office; June 8, 2006.P06-77.
37- Barclay L. Murata P. Guidelines issued for HPV vaccine use to prevent Cervical Cancer. Medscape Medical News. 2007, 57:7-28] http://www.medscape.com
38- Muñoz N. HPV in the Etiologic of Human Cancer. Vaccine. 2006;24 Suppl 3.
39- International Society for Vaccyne. Cervical Cancer Prevention and Control in Region of the Americas. Official Journal of Vaccyne. Special Supl. 2008 May 6; México City.